Halo semuanya~~
Syudah terlalu lama gak sih? Daku sebagai author merasakan rindu pada kalian:")
Engga deng. Yakaliii...
Engga usah rindu-rinduan, sesungguhnya rindu lebih berat daripada gaya berat:).
Nah, materi kali ini adalah gerak parabola, atau gerak peluru. Disebut gerak peluru karena biasanya, peluru ditembakkan ke atas geraknya membentuk parabola. Ya, gitu deh.
Dalam gerak parabola ini, ada baiknya kalian memahami konsep materi GLB dan GLBB dulu, karena materinya cukup berhubungan, dan masih dalam cakupan gerak kinematika.
Misal seseorang yang menendang bola hingga melambung tinggi.
Maka, kita bisa mengetahui jarak terjauh atau jarak tertinggi yang dicapai bola melalui rumus parabola. Dijabarkan vektornya pada sumbu x dan y:
Maka, persamaan matematisnya ada hubungannya dengan gerak lurus
v = kecepatan (m/s)
t = waktu (s)
x = jarak/sumbu-x (m)
h = ketinggian/sumbu-y (m)
1. Pada arah sb-x (bergerak dengan kecepatan konstan - GLB)
Pada saat kecepatan awal di sumbu-x, Vox = Vo cos α. Benda yang bergerak menurut sumbu-x
bergerak dengan kecepatan tetap, maka berlaku konsep GLB.
Untuk sumbu-x, kecepatannya adalah
2. Pada arah sb-y (bergerak dengan percepatan konstan - GLBB)
Benda yang bergerak melambung ke atas, searah dengan sumbu-y mengalami penambahan kecepatan konstan, atau percepatan secara konstan. Sehingga, rumusnya menggunakan konsep GLBB
Untuk sumbu-y ,kecepatannya adalah
t&space;+\frac{1}{2}&space;t^{2})
3. Kecepatan total pada saat tertentu
Dengan menggunakan konsep resultan vektor, maka berlaku
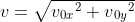
4. Waktu Pada Ketinggian Maksimum
Ada dua cara benda benda berada pada ketinggian maksimum.
Yang pertama ditinjau dari waktu untuk mencapai ketinggian maksimum atau ketika benda naik:

Yang kedua cara untuk menghitung waktu benda dari ketinggian maksimum atau ketika benda turun:

5. Waktu mengudara
Waktu mengudara atau melayang, sama dengan dua kali waktu puncak. Ketika suatu benda dilempar naik, maka ia akan turun juga. Dimana t-naik = t-turun. Sehingga:

6. Menghitung jarak
Untuk menghitung jarak benda secara vertikal atau sumbu-y (ketinggian maksimum)

Untuk menghitung jarak benda secara horizontal atau sumbu-x (jarak maksimum)

supaya engga ketuker rumus antara menghitung jarak dan ketinggian. Kalian lihat yang berbeda di antara kedua rumus itu adalah letak 2 pada sin.
Biar ga lupa, untuk mencari ketinggian, berarti 2 pada sin itu naik (pangkat). kemudian dibagi 2g.
Sedangkan untuk mencari jarak, rumusnya lebih sederhana. Karena jarak menempel di tanah, sehingga 2 pada sin itu menempel ke bawah (dikali).
7. Gerak Setengah Parabola
Biasanya dalam gerak parabola ini juga sering muncul soal di mana benda dilemparkan dari ketinggian di atas tebing. Kayak gini:
Balik lagi ke konsepnya. Bahwa gerak parabola akan mengalami dua macam gerak.
gerak pada sumbu-x (GLB)


gerak pada sumbu-y (GLBB)


Kenapa pada gerak setengah parabola Vx nya bukan Vo.cosα atau Vy nya bukan Vo.sinα?
Kalau kita perhatikan. Vo atau kecepatan awal pada gerak parabola biasa itu memiliki arah sebesar cosα dan sinα,
Sedangkan pada gerak parabola, kecepatan awalnya bergerak horizontal terlebih dahulu. Sehingga dengan konsep GLB, gerak tersebut memiliki Vo.
Nah itulah beberapa konsep gerak parabola. Biar lebih paham, kalian bisa aplikasikan ke soal-soal gerak kinematika yang nanti bakal aku posting di blog ini. So, see ya..
Benda yang bergerak melambung ke atas, searah dengan sumbu-y mengalami penambahan kecepatan konstan, atau percepatan secara konstan. Sehingga, rumusnya menggunakan konsep GLBB
Untuk sumbu-y ,kecepatannya adalah
3. Kecepatan total pada saat tertentu
Dengan menggunakan konsep resultan vektor, maka berlaku
4. Waktu Pada Ketinggian Maksimum
Ada dua cara benda benda berada pada ketinggian maksimum.
Yang pertama ditinjau dari waktu untuk mencapai ketinggian maksimum atau ketika benda naik:
Yang kedua cara untuk menghitung waktu benda dari ketinggian maksimum atau ketika benda turun:
5. Waktu mengudara
Waktu mengudara atau melayang, sama dengan dua kali waktu puncak. Ketika suatu benda dilempar naik, maka ia akan turun juga. Dimana t-naik = t-turun. Sehingga:
Untuk menghitung jarak benda secara vertikal atau sumbu-y (ketinggian maksimum)
Untuk menghitung jarak benda secara horizontal atau sumbu-x (jarak maksimum)
supaya engga ketuker rumus antara menghitung jarak dan ketinggian. Kalian lihat yang berbeda di antara kedua rumus itu adalah letak 2 pada sin.
Biar ga lupa, untuk mencari ketinggian, berarti 2 pada sin itu naik (pangkat). kemudian dibagi 2g.
Sedangkan untuk mencari jarak, rumusnya lebih sederhana. Karena jarak menempel di tanah, sehingga 2 pada sin itu menempel ke bawah (dikali).
7. Gerak Setengah Parabola
Biasanya dalam gerak parabola ini juga sering muncul soal di mana benda dilemparkan dari ketinggian di atas tebing. Kayak gini:
Balik lagi ke konsepnya. Bahwa gerak parabola akan mengalami dua macam gerak.
gerak pada sumbu-x (GLB)
gerak pada sumbu-y (GLBB)
Kenapa pada gerak setengah parabola Vx nya bukan Vo.cosα atau Vy nya bukan Vo.sinα?
Kalau kita perhatikan. Vo atau kecepatan awal pada gerak parabola biasa itu memiliki arah sebesar cosα dan sinα,
Sedangkan pada gerak parabola, kecepatan awalnya bergerak horizontal terlebih dahulu. Sehingga dengan konsep GLB, gerak tersebut memiliki Vo.
Nah itulah beberapa konsep gerak parabola. Biar lebih paham, kalian bisa aplikasikan ke soal-soal gerak kinematika yang nanti bakal aku posting di blog ini. So, see ya..
Sweet beginning but better ending. Gerak parabola mengajarkan kita bahwa hidup itu naik, dan ketika sudah mencapai titik maksimum, ia turun. Tidak ada yang selamanya hidup di atas. Bahkan batas maksimum pun berupa titik. Maka jangan cepat puas ataupun jangan cepat menyerah dalam hidup.













